Asitler ve Bazlar Konu Anlatımı 8.Sınıf fen bilimleri dersinde sorumlu olduğunuz konulardandır. Asitler ve Bazlar Konu Anlatımı soruları daha kolay bir şekilde çözebilmeniz için size yardımcı olacak. Asitler ve Bazlar Konu Anlatımını bu yazımızda anlatıyoruz. Asitler ve Bazlar ile ilgili bilmemiz gereken konu içeriğini şu şekilde sıralayabiliriz:
Asitler ve Bazlar
Asitlerin Genel Özellikleri
- Suda çözündüklerinde suya hidrojen (H+) iyonu veren maddelere asit adı verilir.
- Tatları ekşidir.
- Birçoğu yakıcı ve tahriş edicidir. Canlı dokulara zarar verir.
- Bazı metallerle (Mg, Cu, Zn gibi) tepkimeye girerek metalleri de aşındırır.
- Mermeri aşındırır.
- Mavi turnusol kâğıdını kırmızıya dönüştürür.
- Sulu çözeltileri elektriği iyi iletir.
- Bazlarla tepkimeye girerek tuz ve su oluşturur.
Bazların Genel Özellikleri
- Suda çözündüklerinde suya hidroksit (OH-) iyonu veren maddelere baz adı verilir.
- Tatları acıdır.
- Cildimizde kayganlık hissi oluşturur.
- Bazı metallerle tepkimeye girer ve tepkimeye girdikleri metalleri aşındırır.
- Kırmızı turnusol kâğıdını maviye dönüştürür.
- Sulu çözeltileri elektriği iyi iletir.
- Asitlerle tepkimeye girerek tuz ve su oluşturur.
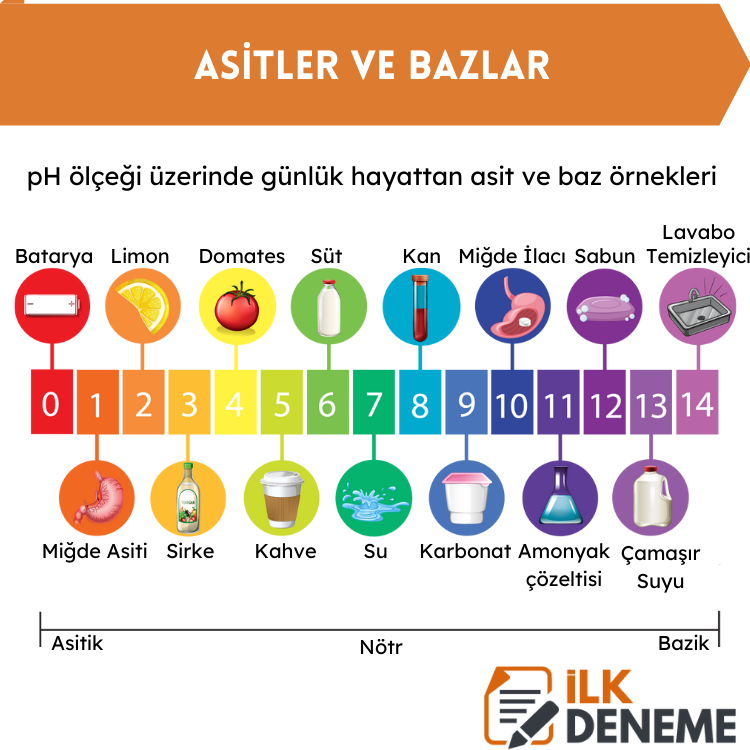
pH Değeri
pH değeri, maddelerin asitlik ya da bazlık derecesini gösteren bir ölçüdür.

Günlük Hayatımızda Asitler ve Bazlar
Günlük hayatımızda tükettiğimiz yiyecekler, içecekler ve kullandığımız temizlik maddeleri farklı asidik ya da bazik özelliğe sahiptir.
| Asit ya da Baz Adı | Formülü | Piyasa Adı | Kullanım Alanları |
| Hidroklorik asit | HCI | Tuz ruhu | Kimya, ilaç, petrol, boya ve tekstil endüstrisinde |
| Nitrik asit | HNO3 | Kezzap | Gübre ve boya endüstrisinde, patlayıcı madde üretiminde |
| Sülfürik asit | H2SO4 | Zaç yağı | Gübre ve boya endüstrisinde, patlayıcı madde üretiminde |
| Sodyum hidroksit | NaOH | Sud-kostik | Temizlik, kâğıt, boya ve yapay ipek endüstrisinde |
| Potasyum hidroksit | KOH | Potas-kostik | Sıvı sabun, kâğıt ve tarım ilacı üretiminde |
| Kalsiyum hidroksit | Ca(OH)2 | Sönmüş kireç | Deri, çimento, alçı ve kireç endüstrisinde |
Asit ve Bazlarla Çalışırken Dikkat Edilecek Hususlar
Kuvvetli asit ve bazların canlı ya da cansız maddelere zarar verici etkileri olabilir. Bu nedenle, asitler ve bazlarla çalışırken dikkat etmemiz gereken bazı hususlar vardır.
- Tüm deneylerde olduğu gibi laboratuvarda asitler ve bazlarla çalışırken laboratuvar önlüğü giyilmeli ve laboratuvar gözlüğü takılmalıdır.
- Asitler ve bazlar cildimizi tahriş edebileceği için, asitler ve bazlar ile çalışırken eldiven kullanılmalıdır.
- Kuvvetli asitler ve kuvvetli bazlar koklanmamalı ya da tadına bakılmamalıdır.
- Asit ya da bazların cildimizi tahriş etmesi durumunda en yakın sağlık kuruluşuna başvurulmalıdır.
- Asitler ve bazlar besinlerden uzak bir yerde saklanmalıdır.
- Asitlerin ve bazların üzerlerindeki tehlike işaretlerine dikkat edilmelidir.
- Asitlerle tepkimeye girerek tuz ve su oluşturur.

Asit Yağmurları
Fosil yakıtların yakılması ile karbon dioksit (CO2), kükürt dioksit (SO2), azot dioksit (NO2) gibi hava kirliliğe neden olan gazlar atmosfere yayılır.
Bu gaz molekülleri, atmosferdeki su buharıyla karşılaşınca kimyasal tepkime meydana gelir ve kimyasal tepkimeler sonucunda nitrik asit, sülfürik asit ve karbonik asit gibi asitler oluşur.
Havadaki bu asitler yağmur, kar ya da sis ile birlikte yeryüzüne iner. Bu olaya asit yağmuru adı verilir.
Asit yağmurlarının oluşmasını sağlayan bir diğer etken de yanardağ faaliyetleridir. Yanardağların atmosfere püskürttüğü kül ve duman, su buharı ile birleşerek asit yağmuru oluşturabilir.
Asit yağmurlarının oluşumu azaltabilmek için aşağıdaki önlemler alınmalıdır:
- Fosil yakıt kullanımının azaltılmalıdır.
- Elektrikli aletler, kullanılmadığı zaman kapatılmalı ve gereksiz enerji tüketimi engellenmelidir.
- Güneş ve rüzgâr enerjisi gibi doğaya dost enerji kaynakları kullanılmalıdır.
- Fabrika bacalarına ve arabaların egzozlarına filtre takılmalıdır.
- Sanayi kuruluşları şehirlerden, tarım arazilerinden ve ormanlardan uzak yerlere inşa edilmelidir.