Maddenin Isı ile Etkileşimi Konu Anlatımı 8.Sınıf fen bilimleri dersinde sorumlu olduğunuz konulardandır. Maddenin Isı ile Etkileşimi Konu Anlatımı soruları daha kolay bir şekilde çözebilmeniz için size yardımcı olacak. Maddenin Isı ile Etkileşimi Konu Anlatımını bu yazımızda anlatıyoruz. Maddenin Isı ile Etkileşimi ile ilgili bilmemiz gereken konu içeriğini şu şekilde sıralayabiliriz:
Öz Isı
Bir maddenin birim kütlesinin sıcaklığını 1 °C değiştirmek için alınan ya da verilen ısıya öz ısı denir. Saf maddeler için bu ısı miktarı bir maddeden diğerine farklılık gösterir. Bu nedenle, öz ısı maddenin ayırt edici özelliklerinden biridir.
Bazı Maddelerin Öz Isıları
| Madde | öz ısı (J/g °C) |
| Hidrojen | 14,32 |
| Su | 4,18 |
| Alkol | 2,40 |
| Alüminyum | 0,90 |
| Demir | 0,45 |
| Bakır | 0,39 |
| Kurşun | 0,13 |
| Cıva | 0,12 |
Öz ısı değeri yüksek olan maddeler, öz ısı değeri az olan maddelere göre daha geç ısınıp geç soğurlar. Bu yüzden; özdeş ısıtıcılarla ısıtılan, eşit kütleli, öz ısıları farklı maddelerin sıcaklığını eşit miktarda arttırabilmek için, öz ısısı fazla olan maddeye daha fazla ısı vermek gerekir.
Günlük Yaşamda Öz Isı
Suyun öz ısısının diğer maddelerinkinden çok daha yüksek olduğunu görürüz. Bunun günlük yaşamamızda etkileri oldukça fazladır.
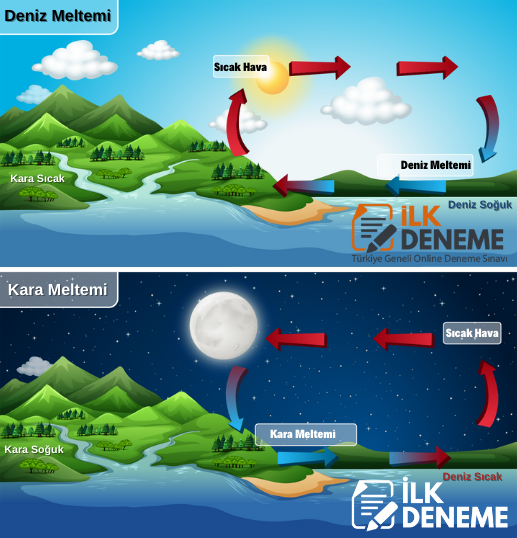
Gündüz vakti, karalar denizden daha çabuk ısınır ve denizden karaya doğru serin rüzgârlar (gündüz meltemi) eser. Akşamları karalar denizlerden daha çabuk soğuduğu için de karadan denize doğru serin rüzgârlar (gece meltemi) eser.
Ocağın üzerine koyulan bir tencerenin metal kısmının sıcaklığı, tencerenin kulpunun sıcaklığından çok daha kısa bir sürede artar.
Bunun nedeni, tencerelerin kulpunun öz ısı değerinin, tencerenin metal kısmının öz ısı değerinden çok daha yüksek olmasıdır. Böylece, yemek yaparken elimiz yanmadan tencerenin kulpunu tutabiliriz.
Sıcaklık ve Isı
Maddeyi oluşturan tanecikler hareketlidir. Her bir taneciğinin hızı birbirinden farklı olduğundan bu parçacıkların hızlarını hesaplamak yerine, sahip oldukları ortalama kinetik enerji belirlenebilir.
Isı Miktarı, Kütle, Öz Isı ve Sıcaklık Değişimi Arasındaki İlişki
Isı Miktarı – Kütle İlişkisi
Aynı maddeden farklı miktarda örnekler alıp sıcaklıklarını eşit miktarda arttırdığımızda, kütlesi fazla olan madde için fazla ısı gerektiğini gözlemleriz. Kütlesi fazla olan maddenin ortalama kinetik enerjisinin arttırılması için daha fazla ısı aktarılması gerekir çünkü içinde bulunan tanecik sayısı daha fazladır.
Kütle – Sıcaklık Değişimi İlişkisi
Aynı maddeden eşit kütleler alıp, eşit miktarda ısı verildiğinde kütlesi fazla olanın sıcaklık değişiminin az olduğunu gözlemleriz.
Isı Miktarı – Sıcaklık Değişimi İlişkisi
Aynı maddeden eşit kütleler alıp farklı miktarda ısı verince, fazla ısı verilen maddenin sıcaklık değişiminin fazla olduğunu gözlemleriz.
Isı – Öz Isı İlişkisi
Farklı maddelerden eşit kütleler alıp sıcaklığını eşit miktarda arttırdığımızda, öz ısı değeri fazla olan madde için daha fazla ısı gerektiğini gözlemleriz.
Maddenin Hâlleri ve Bağ Kuvvetliliği
- Maddeler katı, sıvı veya gaz hâlinde bulunabilir. Maddeleri oluşturan tanecikler arasında kuvvetli ve zayıf çekim kuvvetleri bulunur.
- Kuvvetli çekim kuvvetleri kimyasal bağ olarak adlandırılır. Zayıf çekim kuvvetlerinin büyüklüğü ise maddenin katı, sıvı veya gaz hâlinde oluşuna göre değişir.
- Katı hâldeki maddelerin tanecikleri arasındaki boşluk oldukça azdır, ve bu nedenle tanecikler sadece titreşim hareketi yapabilir. Tanecikler arasındaki çekim kuvveti en fazla olan katılardır.
- Sıvı hâldeki maddelerin tanecikleri arasındaki boşluk, katı hâldeki maddelerin tanecikleri arasındaki boşluktan biraz daha fazladır. Bu nedenle sıvı hâldeki maddelerin tanecikleri titreşim hareketinin yanı sıra öteleme hareketi de yapar.
- Sıvı hâldeki taneciklerin arasındaki çekim kuvveti katilara göre daha azdır.
- Gaz hâldeki maddelerin tanecikleri arasında oldukça büyük boşluklar vardır. Gaz tanecikleri sürekli hareket hâl indedir, titreşim ve öteleme hareketi yapar.
- Gaz hâldeki taneciklerin arasındaki çekim kuvveti sıvılara ve katılara göre zayıftır.

Isı Alış-verişi ve Hâl Değişimi
Erime, donma, buharlaşma ve yoğuşma gibi hâl değişimi olaylarında bağ kuvvetliliğine bağlı olarak ısı ihtiyacı da değişir.
Katı hâldeki bir maddenin sıvı hâle gelmesi yani erimesi sırasında katı tanecikleri arasındaki bağlar kopar ve tanecikler arasındaki boşluklar artar.
Bunun için ısıya ihtiyaç duyulur. Aynı durum sıvı hâldeki maddenin gaz hâline geçmesi, yani buharlaşması sırasında da gözlemlenir.
Sıvı hâldeki maddenin katı hâle geçmesi yani donması sırasında sıvı tanecikleri arasındaki bağlar kuvvetlenir ve yeni bağlar oluşur ve tanecikler arasındaki boşluk azalır.
Bağ oluşumu esnasında madde, enerji kaybeder ve cismin kaybettiği bu ısı ortama verilir. Aynı durum gaz hâldeki maddenin sıvı hâle geçmesi yani yoğuşması sırasında da gözlemlenir.
